الغازات من أهم حالات المادة التي تتميز بخصائص فريدة، حيث تتحرك جزيئاتها بحرية وتنتشر في جميع الاتجاهات، وفهم سلوك الغازات يساعدنا على تفسير الكثير من الظواهر الطبيعية والصناعية، ومن أبرز ما يوضح طبيعة الغازات علاقتها بالضغط ودرجة الحرارة والقوانين التي تحكمها مثل قانون بويل.
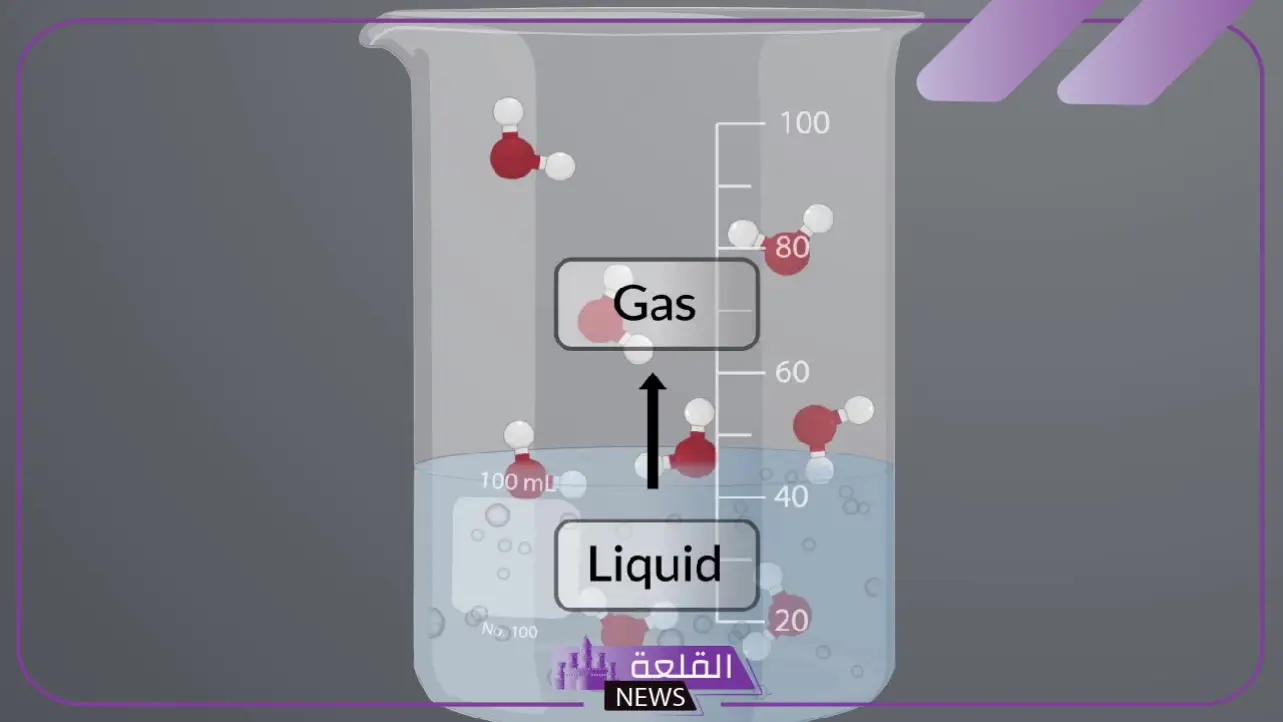
تتكثف جزيئات الغاز في حالة:
- عندما تنخفض درجة حرارة الغاز تبدأ جزيئاته بفقدان طاقتها الحركية، مما يقلل من المسافات بينها ويؤدي إلى تقاربها وتكثفها حتى تتحول إلى سائل.
- عند زيادة الضغط الواقع على الغاز تقل المسافة بين جزيئاته، فيحدث التكثف بشكل أسرع.
- تحدث عملية التكثف بشكل واضح في الطبيعة مثل تكون قطرات الندى أو السحب عندما يبرد بخار الماء.
- تتأثر سرعة التكثف بخصائص الغاز نفسه، فبعض الغازات تحتاج إلى ضغط شديد وحرارة منخفضة جدًا لتتكثف.
- التكثف يمثل انتقالًا من الحالة الغازية إلى الحالة السائلة، وهو عكس عملية التبخر.
كيف تؤثر درجة الحرارة في جزيئات الغاز
- عند ارتفاع درجة الحرارة تزداد سرعة حركة جزيئات الغاز نتيجة اكتسابها طاقة حركية أكبر.
- انخفاض درجة الحرارة يقلل من حركة الجزيئات ويزيد من احتمالية تقاربها وتكثفها.
- كلما ارتفعت الحرارة تمدد الغاز وزاد حجمه لأن الجزيئات تحاول الابتعاد عن بعضها.
- درجة الحرارة المرتفعة تجعل الضغط داخل الغاز يزداد إذا كان محصورًا في وعاء مغلق.
- العلاقة بين الحرارة وحركة الجزيئات علاقة طردية، أي بزيادة الأولى تزداد الثانية بشكل مباشر.
قانون بويل
- ينص قانون بويل على أن حجم الغاز يتناسب عكسيًا مع الضغط الواقع عليه عند ثبوت درجة الحرارة.
- بمعنى أنه كلما زاد الضغط قل حجم الغاز، وكلما انخفض الضغط زاد الحجم.
- هذا القانون يفسر الكثير من التطبيقات مثل عمل أجهزة التنفس والغوص في أعماق البحار.
- يرتبط القانون بخصائص الجزيئات حيث يوضح كيف يتغير توزيعها داخل الوعاء عند تغير الضغط.
- يعتبر قانون بويل أحد الأسس في دراسة الغازات ويشكل قاعدة مهمة في الكيمياء والفيزياء.
الغازات تتأثر بشكل مباشر بالحرارة والضغط، والتكثف أحد أبرز مظاهر هذا التأثير، ومع قوانين مثل قانون بويل نستطيع فهم سلوكها بدقة وتطبيق ذلك في حياتنا العلمية والعملية.